《大摩VS大和》信達生物新藥不獲批連日急跌今急彈 大摩睇$65大和$26
15/02/2022
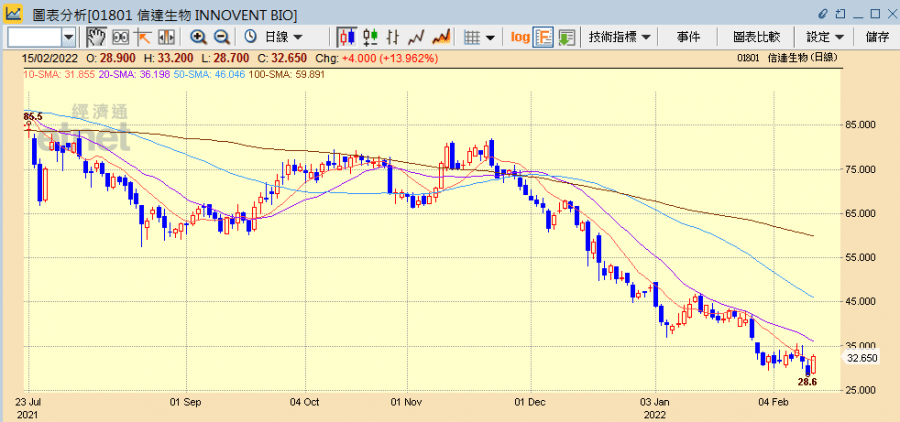
早前信達生物(01801)的腫瘤新藥信迪利單抗(Sintilimab)遭美國食物藥品監督管理局(FDA)拒絕上市申請,隨即遭多間大行降低目標價,其中大和更將其降至遜於大市評級,目標價也大降近五成至26元,股價連續兩日急跌。大摩雖亦將其目標價降至65元,惟維持增持評級,指其股價已過度調整,今日(15日)信達生物反彈逾一成,另有內媒引述研究報告指,全球口服新冠藥物市場規模達數十億至上百億美元,而內地多家藥企早已研發,帶動其他醫藥股今早也普遍造好。

(信達生物網頁截圖)
大摩:產品管線價值被嚴重低估 股價已過度調整
信達生物早前公布,FDA召開腫瘤藥物諮詢委員會,對公司與禮來製藥共同開發的信迪利單抗的上市申請進行投票,建議需要在獲批前補充額外臨床試驗,證明其在美國人群和美國醫療實踐中的適用性。
摩根士丹利發表研究報告指,信達生物的產品管線價值被嚴重低估,股價已經過度調整。信達生物產品具有廣度及深度,產品管線包括6種商業化產品,其中5種將在未來兩年內商業化,預期全球化發展布局不會受到影響,現價水平存在投資機會,維持「增持」評級。FDA仍未對公司主要產品信迪利單抗作出最終審批,不過基於對其銷售預期更為保守,下調信達生物2021至23年收入及盈利預測,目標價相應由95元下調至65元。
大和:今年不可能獲批 降至遜於大市評級
另大和指,信迪利單抗不太可能在今年獲得FDA的批准。雖然仍然看好其產品管線,但這些產品需要數年時間才能成熟。2022年缺乏股價催化劑,將其2022至23年銷售預測下調19至20%,將目標價由48元大幅下調46%至26元,並將其評級由「優於大市」降至「遜於大市」。
瑞信亦指,信迪利單抗於FDA的批核較預期負面,FDA引用2016年文章指超過80%中國的藥物註冊臨床數據是「欺詐或不合格」,反映美方對中國藥物註冊臨床數據的負面看法。如果信達生物PD-1藥物銷售優於預期,或會令股價有驚喜,維持其「優於大市」評級,惟目標價由75元下調22.67%至58元。
美銀:料審批推遲至2024年 目標價降至39.5元
美銀證券預期信迪利單抗上市申請的審批將由今年推遲至2024年,並減少銷售點。由於禮來公司可能降價,因此下調中國以外市場的銷售預測,並將目標價由69.7元降至39.5元。但信迪利單抗作為納入國家醫保目錄的首款單抗產品,中國市場峰值銷售額仍可能達到30億元人民幣以上,同時公司產品管線豐富,提供可持續增長動力,重申「買入」評級。
瑞銀指,FDA要求信達生物就信迪利單抗提供更多臨床研究並拒絕上市,結果大致符市場預期,但公司以單一國家實驗而未能反映多樣性,才是主要憂慮。為反映信迪利單抗海外上市不確定性,將其成功率由75%下調至60%。不過,管理層稱與美國監管機構交手所獲經驗可能有助全球化策略,維持「買入」評級,目標價由65元降7.7%至60元。
口服新冠藥市場規模達上百億美元 內地多家藥企早已研發
醫藥板塊也有其他好消息。據內媒引述研究報告,全球口服新冠藥物市場規模為數十億至上百億美元,內地多家藥企或研究機構也早已在新冠口服藥的研發路上,其中開拓藥業(09939)最近公布用於治療新冠患者的「普克魯胺」正進行全球III期臨床試驗,並已在深圳市第三人民醫院完成中國首例受試者入組及給藥。歌禮製藥(01672)則宣布向歐洲多個國家遞交利托那韋上市許可申請,又持續與國內和國際公司,包括大型跨國製藥公司,就利托那韋在中國和全球的商業化供應進行合作洽談。另君實生物(01877)目前在研四款新冠治療藥物,包括兩款口服治療藥物。
醫藥股今早普遍上升,信達生物半日升13.96%收報32.65元,成交5.16億元。開拓藥業升3.31%報12.5元,歌禮製藥升1.11%報4.57元,君實生物亦曾升逾3%,惟半日則跌3.74%報45.05元。而早前受累納入美國「未經核實」名單而連跌多日的藥明生物(02269)也回升8.13%收報60.55元,為表現最佳藍籌,同系藥明康德(02359)亦升9.98%報99.75元。另近日宣布擬斥最多5億人幣回購A股的泰格醫藥(03347)升5.32%報78.15元,石藥(01093)則升1.06%報9.51元,中生製藥(01177)升1.1%報5.53元。
(經濟通HV2系統截圖)
撰文:經濟通市場組、中國組、採訪組 整理:李崇偉
重溫《開市Good Morning》黃瑋傑詳盡分析,請按此
其他藥股相關新聞:
《中資異動》信達生物升逾14%突破10天線,報32﹒8元
《A股焦點》高瓴上季仍重倉CXO概念股,振奮百濟神州A漲4%
《異動股》信達生物升逾11%,大摩維持「增持」評級
《異動股》藥明生物升近8%暫為最佳藍籌,醫藥股造好
樂本健【年度感謝祭】維柏健及natural Factors全線2件7折► 了解詳情












































